ตารางธาตุ(periodic table)
ตารางธาตุ (อังกฤษ: Periodic table) คือ ตารางที่ใช้แสดงรายชื่อธาตุเคมี ซึ่งจัดเรียงบนพื้นฐานของเลขอะตอม (จำนวนโปรตอนในนิวเคลียส) การจัดเรียงอิเล็กตรอน และสมบัติทางเคมี โดยจะเรียงตามเลขอะตอมที่เพิ่มขึ้น ซึ่งจะระบุไว้ในร่วมกับสัญลักษณ์ธาตุเคมี ในกล่องของธาตุนั้น ตารางธาตุมาตรฐานจะมี 18 หมู่และ 7 คาบ และมีคาบพิเศษเพิ่มเติมมาอยู่ด้านล่างของตารางธาตุ ตารางยังสามารถเปลี่ยนเป็นการจัดเรียงตามบล็อก โดย บล็อก-s จะอยู่ซ้ายมือ บล็อก-p จะอยู่ขวามือ บล็อก-d จะอยู่ตรงกลางและบล็อก-f อยู่ที่ด้านล่าง
แถวแนวนอนในตารางธาตุจะเรียกว่า คาบ
แถวในแนวตั้งเรียกว่า หมู่
โดยหมู่บางหมู่จะมีชื่อเฉพาะ เช่นแฮโลเจน หรือแก๊สมีตระกูล โดยคำนิยามของตารางธาตุ ตารางธาตุยังมีแนวโน้มของสมบัติของธาตุ เนื่องจากเราสามารถใช้ตารางธาตุบอกความสัมพันธ์ระหว่างสมบัติของธาตุแต่ละตัว และใช้ทำนายสมบัติของธาตุใหม่ ธาตุที่ยังไม่ถูกค้นพบ หรือธาตุที่สังเคราะห์ขึ้น และด้วยความพิเศษของตารางธาตุ ทำให้มันถูกใช้อย่างกว้างขวางในการศึกษาวิชาเคมีหรือวิทยาศาสตร์สาขาอื่น ๆ
ดมีตรี เมนเดเลเยฟ รู้จักกันในฐานะผู้ที่ตีพิมพ์ตารางธาตุในลักษณะแบบนี้เป็นคนแรก ใน พ.ศ. 2412 เขาจัดตารางธาตุโดยเรียงตามสมบัติทางเคมีของธาตุ และเมนเดเลเยฟยังสามารถทำนายธาตุที่ยังไม่ค้นพบ โดยเขาเชื่อว่ามันจะเติมเต็มช่องว่างในตารางธาตุของเขาได้ การทำนายของเขาส่วนใหญ่ค่อนข้างใกล้เคียงกับสมบัติจริงของธาตุ ตารางธาตุของเขาก็ขยายเพิ่มขึ้นด้วยการค้นพบธาตุใหม่เรื่อย ๆ และก็มีการพัฒนาแบบจำลองทางทฤษฎีที่ใช้อธิบายพฤติกรรมของธาตุเคมีใหม่ ๆ เหล่านั้น
การจัดธาตุลงในตารางธาตุ
ตารางธาตุประกอบด้วยธาตุ 8 หมู่
1.ธาตุหมู่ I มีสมบัติเป็นโลหะซึ่งมีคุณสมบัติว่องไวในการผสมธาตุมาก ธาตุหมู่ I เรียกว่า alkalai metal และมีอิเล็กตรอนวงนอกสุดอยู่ 1 ตัว
2.ธาตุหมู่ II เป็นธาตุโลหะ มีอิเล็กตรอนวงนอกสุด 2 ตัว ธาตุที่ว่องไวที่สุดในหมู่นี้ คือเรเดียม (Ra)
3.ธาตุหมู่ III จะเริ่มประกอบด้วยโลหะและอโลหะ มีอิเล็กตรอนวงนอกสุด 3 ตัว
4.ธาตุหมู่ IV มีอิเล็กตรอนวงนอกสุด 4 ตัว
5.ธาตุหมู่ V ในตอนต้น ๆ จะเป็นอโลหะ ธาตุถัดมา เช่น สารหนู (As) และอันติโมนี (Sb)
จะแสดงคุณสมบัติระหว่างโลหะและอโลหะ ก้ำกึ่งกัน ลักษณะเช่นนี้เรียกว่ามีสมบัติเป็น metalloid
6.ธาตุหมู่ VI ตอนต้นหมู่จะมีธาตุที่มีสมบัติเป็นอโลหะ แล้วค่อย ๆ เป็นโลหะ
7.ธาตุหมู่ VII มีชื่อเรียกว่า Halogen group ธาตุหมู่นี้เป็นอโลหะ ที่ว่องไวในการผสมธาตุมาก
8.ธาตุหมู่ VIIIจัดเป็นธาตุ Inert gas จึงไม่ค่อยทำปฏิกิริยากับธาตุอื่น เพราะมีอิเล็กตรอนวงนอกสุดเท่ากับ8
ลักษณะสำคัญของธาตุภายในหมู่เดียวกัน
- ธาตุที่อยู่ในหมู่เดียวกันมีจำนวนเวเลนซ์อิเล็กตรอนเท่ากัน จึงทำให้มีสมบัติคล้ายกัน
เช่น ธาตุลิเทียม (3Li) และธาตุโซเดียม (11Na) ต่างก็มีเวเลนซ์อิเล็กตรอนเท่ากับ1ทั้งสองธาตุจึงมีคุณสมบัติคล้ายกัน เป็นต้น
- ธาตุในหมู่ย่อย A (IA -VIIIA) มีเวเลนซ์อิเล็กตรอนเท่ากับเลขที่ของหมู่ ยกเว้นธาตุแทรนซิชัน
ลักษณะสำคัญของธาตุภายในหมู่เดียวกัน เช่น ธาตุในหมู่ I จะมีเวเลนซ์อิเล็กตรอนเท่ากับ 1 ธาตุในหมู่ II จะมีเวเลนซ์อิเล็กตรอนเท่ากับ 2 เป็นต้น
- ธาตุแทรนซิชันส่วนใหญ่มีเวเลนซ์อิเล็กตรอนเท่ากับ 2 ยกเว้นบางธาตุ เช่น Cr , Cu เป็นต้น จะมีเวเลนซ์อิเล็กตรอนเท่ากับ 1
ลักษณะสำคัญของธาตุในคาบเดียวกัน
- ธาตุในคาบเดียวกันมีเวเลนซ์อิเล็กตรอนไม่เท่ากัน โดยมีเวเลนซ์อิเล็กตรอนเพิ่มขึ้นจากซ้ายไปขวา ยกเว้นธาตุแทรนซิชันซึ่งส่วนใหญ่มีจำนวนเวเลนซ์อิเล็กตรอนเท่ากับ 2 เท่ากัน จึงมีคุณสมบัติคล้ายกันทั้งในหมู่และในคาบเดียวกัน
- ธาตุในคาบเดียวกันมีจำนวนระดับพลังงานเท่ากัน และเท่ากับเลขที่ของคาบ เช่น ธาตุในคาบที่ 2 ทุกธาตุ (Li ถึง Ne) ต่างก็มีจำนวนระดับพลังงานเท่ากับ 2 คือ ชั้น K (n=1) และชั้น L (n=2) เป็นต้น
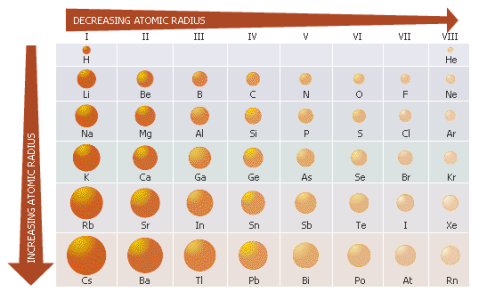
แนวโน้มของขนาดอะตอม
ปัจจัยที่มีผลต่อขนาดอะตอม
- จำนวนชั้นของอิเล็กตรอน ถ้าจำนวนชั้นมากจะมีอะตอมขนาดใหญ่
- ถ้าชั้นอิเล็กตรอนเท่ากัน ให้ดูที่จำนวนโปรตอน ถ้าจำนวนโปรตอนมาก อะตอมหรือไอออนนั้นจะมีขนาดเล็ก
- อัตราส่วนของ p+/e
ถ้าไอออนของธาตุใดมีค่า p+/e มาก จะมีขนาดของอะตอมเล็ก
ถ้าไอออนที่มีค่า p+/e น้อย จะมีขนาดของอะตอมใหญ่
แนวโน้มของขนาดไอออน
ขนาดของอะตอมเปรียบเทียบกับขนาดไอออนบวก
ไอออนบวก คือ อะตอมที่เสียอิเล็กตรอน ดังนั้นจะมีจำนวนอิเล็กตรอนน้อยลง ในขณะที่โปรตอนเท่าเดิม
ขนาดของอะตอมเปรียบเทียบกับขนาดไอออนลบ
ไอออนลบมีจำนวนเวเลนซ์อิเล็กตรอนเพิ่มขึ้น แต่จำนวนโปรตอนเท่าเดิม
ที่มา :
http://sciencenotes.org/periodic-table-wallpaper-2/
ศึกษาเพิ่มเติมที่
URL link : http://arisatawoncha.blogspot.com/2012/10/blog-post.html
VDO link :